⇧ [VIDÉO] Potrebbero piacerti anche questi contenuti dei partner
I ricercatori hanno identificato un complesso proteico che funge da “interruttore” per attivare e disattivare l’enzima ciclico GMP-AMP sintasi, una sentinella che rileva il DNA patogeno e stimola la risposta immunitaria. La regolazione di questo percorso è essenziale per impedire al sistema immunitario di attaccare le cellule del corpo. Puntare su questo composto potrebbe aprire la strada a nuove strategie contro le malattie autoimmuni e contribuire a migliorare l’efficacia delle immunoterapie contro il cancro.
La penetrazione di un corpo estraneo nel nostro organismo innesca una serie complessa di risposte, governate dal sistema immunitario. Tra i componenti chiave di questa cascata c’è l’enzima ciclico GMP-AMP sintasi (cGAS), che funge da sentinella per rilevare il DNA di agenti patogeni o di cellule difettose (nel caso del cancro). Durante la mitosi, quando l'involucro nucleare si disintegra, il cGAS viene rapidamente reclutato nel nucleo e si associa ai nucleosomi.
Una volta legato al nucleosoma, l'enzima viene generalmente inattivato in assenza di DNA estraneo (o aberrante). Questo stato si ottiene attraverso uno stretto legame in un sito specifico sulla cromatina. D'altra parte, il nucleosoma riceve una protezione aggiuntiva grazie alla presenza di una proteina architettonica chiamata BAF, che protegge il DNA a doppio filamento dal legame attivo con cGAS. L'associazione con il nucleosoma e la competizione con le proteine dell'architettura della cromatina prevengono congiuntamente l'attivazione del cGAS da parte del DNA genomico dell'ospite.
L'intero processo deve essere attentamente regolato per non innescare una risposta autoimmune, caratteristica delle malattie infiammatorie, che colpiscono circa il 10% della popolazione mondiale. ”
Rappresenta un equilibrio in evoluzione tra la preparazione immunitaria e la protezione dell’integrità del genoma cellulare », Spiegazione in A Ho riferito I ricercatori provengono dall’École Polytechnique Fédérale de Lausanne (EPFL) in Svizzera.
Tuttavia, il modo in cui le cellule coordinano la presenza di cGAS a livello della cromatina e le risposte avviate sono in gran parte fraintese. ” La domanda è come la cellula coordina tutto ciò con le altre funzioni quotidiane », hanno annunciato gli esperti dell'EPFL, che hanno indagato la questione in un nuovo studio recentemente pubblicato sulla rivista natura.
Un bersaglio promettente per le malattie autoimmuni
Per studiare come il cGAS interagisce con il nucleosoma, i ricercatori hanno utilizzato tecniche avanzate di imaging molecolare sulle cellule viventi. Le interazioni tra l'enzima e vari complessi proteici sono state osservate a livello atomico utilizzando la biologia strutturale, la biochimica e la biologia cellulare.
Hanno scoperto che durante la mitosi, l'enzima migrava rapidamente verso il nucleo per legarsi al nucleosoma, il che è coerente con le osservazioni precedenti. Il livello di cGAS nucleare diminuisce quindi gradualmente man mano che il ciclo di divisione cellulare continua. Allo stesso tempo, aumenta il livello citosolico dell'enzima.
Il legame del cGAS al nucleo è mediato da un complesso proteico chiamato CRL5-SPSB3, la cui attivazione porta alla distruzione del nucleo in presenza di DNA patogeno o aberrante. Nello specifico, CRL5-SPSB3 aggiunge ubiquitina (un'altra proteina) al cGAS, attivando la via di segnalazione dell'interferone di tipo I (IFN1), che è essenziale per la distruzione dei complessi proteici tossici. ” L'interferenza con la degradazione del cGAS nucleare regolata da SPSB3 prepara le cellule per la segnalazione dell'interferone di tipo I, conferendo una maggiore protezione contro l'infezione da virus del DNA. “, scrivono gli esperti nel loro studio.
Guarda anche

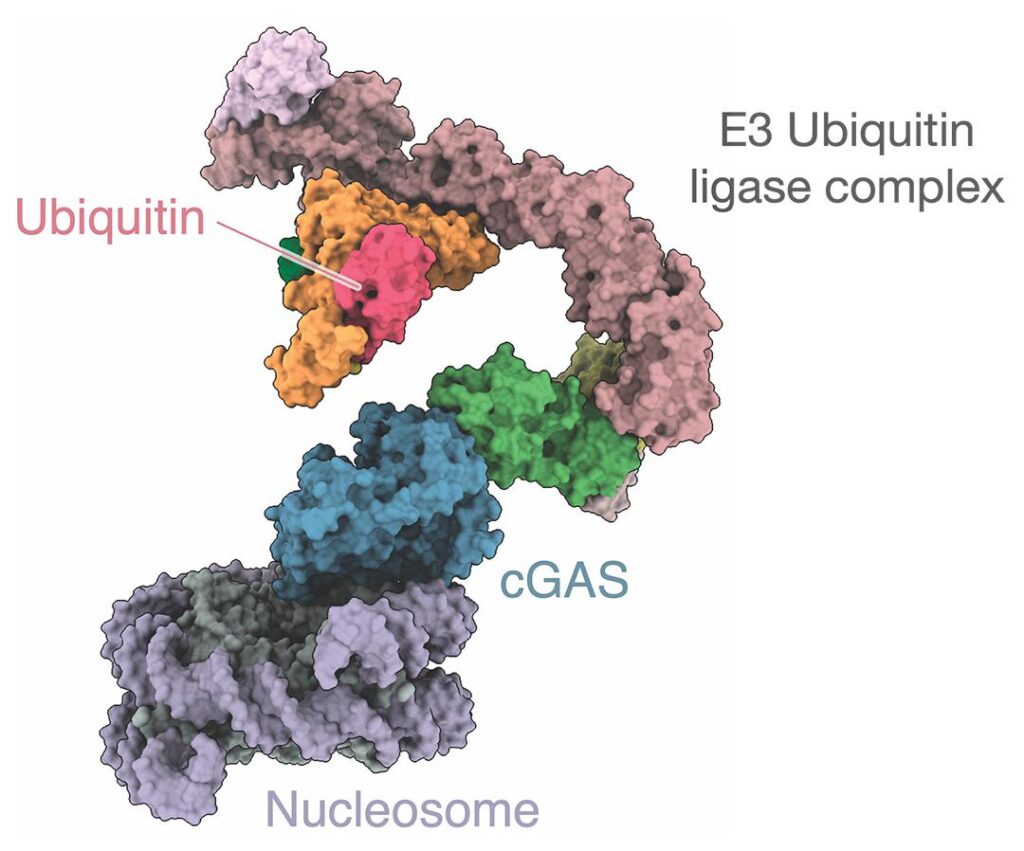
cGAS con ubiquitina attaccata. © Shaw et al.
D’altra parte, l’“ubiquitinazione” del cGAS porta anche alla sua graduale inattivazione, poiché i complessi proteici tossici vengono degradati. Inoltre, CRL5-SPSB3 disattiva rapidamente l'enzima quando le cellule sono sane. Ciò significa che questo composto agisce come un interruttore, attivando o disattivando il cGAS a seconda delle esigenze della cellula.
Questi risultati suggeriscono che questo complesso proteico potrebbe essere un promettente bersaglio terapeutico, sia contro le malattie autoimmuni, che contro il cancro o l’infiammazione cronica. Queste condizioni sono particolarmente caratterizzate da una risposta immunitaria peggiorata o da un sistema immunitario insufficientemente attivo. Tuttavia, saranno necessarie ulteriori ricerche per determinare con precisione come controllare questo percorso in modo mirato ed efficace.
fonte : natura

“Pioniere del caffè a misura di hipster. Creatore amichevole. Analista pluripremiato. Scrittore. Studioso di cibo. Drogato di televisione. Ninja di Internet.”
