⇧ [VIDÉO] Potrebbero piacerti anche questi contenuti dei partner
I ricercatori hanno sviluppato una nuova tecnica di modifica genetica per rimodellare l'intero genoma. Si chiama “bridge editing” e consente, tra le altre cose, di apportare modifiche molto più significative di quelle attualmente possibili con CRISPR, in particolare inserendo nuove sequenze di DNA direttamente nel genoma. Ciò gli conferisce un livello di precisione mai raggiunto prima con le attuali tecniche di editing.
I sistemi guidati dall’RNA hanno rivoluzionato la nostra comprensione del genoma. Uno di questi sistemi è la tecnologia di modifica genetica CRISPR, che agisce come “forbici” molecolari dirette da RNA guida (gRNA). Questa tecnologia consente, tra le altre cose, di segmentare e modificare specifiche sequenze genetiche personalizzando il gRNA.
L'intero processo viene eseguito dalla proteina CRISPR Cas. Il termine Cas si riferisce a una breve endonucleasi legante CRISPR RNA (crRNA) che prende di mira sequenze di DNA o RNA rilevanti. L'endonucleasi Cas9 e Cas12 scindono il DNA, mentre Cas13 scindono l'RNA. Quando lo strumento molecolare taglia la sequenza da prendere di mira, la cellula stimola sistematicamente il processo di riparazione. La mitosi viene eseguita ripetutamente finché la cellula non si trasforma normalmente provocando la riparazione degli errori.
Tuttavia, sebbene CRISPR permetta di indurre mutazioni in siti specifici, il suo livello di accuratezza è relativamente limitato. Taglia e distrugge le sequenze target per disabilitarle, rendendola più una tecnica distruttiva che una tecnica di editing.
Per affrontare questo problema, sono state proposte versioni migliorate di CRISPR, che consentono ad esempio di modificare direttamente le sequenze bersaglio anziché fare affidamento su cicli di riparazione delle mutazioni. Alcuni di essi consentono di modificare le basi nucleotidiche senza passare attraverso il processo di scissione, mentre altri consentono di convertire i gRNA in DNA e inserirli nella sequenza bersaglio. Tuttavia, anche in questo caso, la precisione rimane limitata.
Un team dell’Ark Institute, UC Berkeley, Stanford e Tokyo propone una nuova tecnologia di editing programmabile che consente di inserire nuove sequenze di DNA direttamente nel genoma utilizzando “ponti RNA” – una nuova classe di RNA guida. Ciò migliorerebbe notevolmente la precisione dell’editing genetico utilizzando una singola sequenza di input.
” Il sistema ponte dell’RNA è un meccanismo fondamentalmente nuovo per la progettazione del genoma », spiega in A
Post del blog dell'Arca Institute Il ricercatore principale dello studio, Patrick Hsu, è anche professore di bioingegneria presso l'Università della California, Berkeley. ” La ricombinazione del ponte può modificare globalmente il materiale genetico attraverso inserimenti, escissioni, inversioni di sequenze specifiche e altro ancora, consentendo l’editing del genoma dal vivo in modo più efficiente rispetto a CRISPR. “.
“Bridge RNA”: un adattatore universale che permette di colpire qualsiasi parte del genoma
Il nuovo sistema di editing molecolare, scoperto nei batteri e negli archaea, si basa su una sequenza chiamata inserzione 110 (IS110). Fa parte di un ampio gruppo di sequenze trasponibili (o “geni saltatori”) che attraversano il genoma, si muovono al suo interno e quindi si attaccano (o si inseriscono) tra due filamenti specifici.
Queste brevi sequenze sono presenti nelle cellule di tutti gli organismi viventi e si sono evolute in veri e propri strumenti di manipolazione del DNA. L'IS110 in particolare è costituito da un gene che codifica per un enzima ricombinasi, responsabile della ricombinazione genetica. È un processo che modifica la connessione fisica tra due pezzi di DNA.
Esperti in un nuovo studio – pubblicato sulla rivista
natura -La microscopia elettronica criogenica è stata utilizzata per studiare la struttura molecolare del complesso di riassemblaggio del ponte dell'RNA. Sono progrediti in fasi dal processo di scissione IS110 alla fase di ricombinazione.
Hanno scoperto che quando IS110 viene eliminato dal genoma, le estremità non codificanti del filamento di DNA si uniscono per produrre due anelli di RNA. Un anello si lega a IS110 mentre l'altro si lega al filamento bersaglio in cui verrà inserita la nuova sequenza, rendendo il ponte di RNA il primo esempio di gRNA bispecifico. La ricombinasi catalizza quindi il processo di inserimento.
D'altra parte, ciascun ponte di RNA è programmabile, rendendo possibile legare qualsiasi sequenza di DNA bersaglio e donatore. In altre parole, lo strumento consente di inserire qualsiasi sequenza di DNA in qualsiasi posizione genomica mirata. ” I ponti RNA programmabili distinguono IS110 da altri processi di ricombinazione noti, che non contengono un componente RNA e non possono essere programmati. “, spiega il coautore dello studio Nicholas Berry, anche lui dell'Ark Institute e dell'Università della California. Per quanto riguarda l'analogia, “è come se il bridge ARN fosse un adattatore di alimentazione universale che rende l'IS110 compatibile con qualsiasi porta”, dice .
Guarda anche

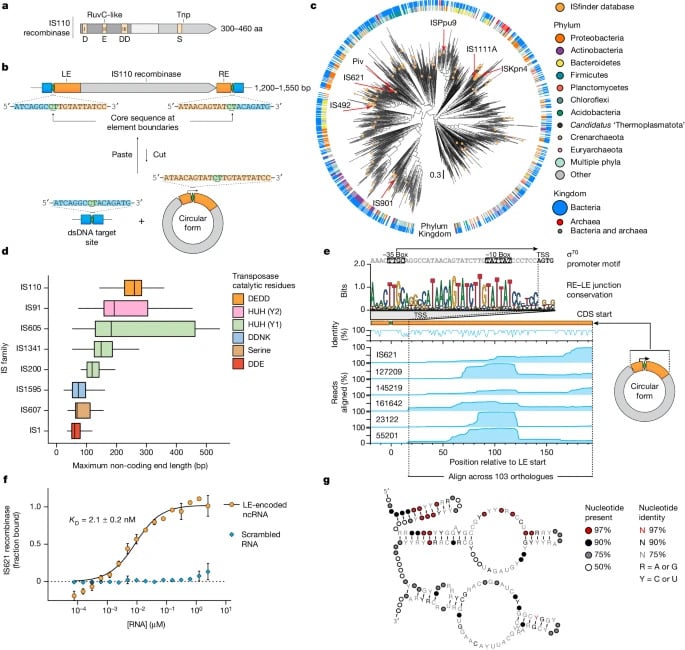
Gli elementi genetici mobili IS110 esprimono un ncRNA (non codificante) associato a una ricombinasi codificata. ARappresentazione schematica della sequenza della proteina ricombinante IS110. BRappresentazione schematica della struttura e del ciclo di vita di un elemento IS110. controun albero filogenetico con radice media costruito da 1.054 sequenze di ricombinasi IS110. DottDistribuzione delle lunghezze terminali non codificanti in otto famiglie IS. Hgrafico di copertura della sequenza di RNA delle estremità della sequenza non codificante di IS621 e di cinque ortologi correlati espressi dal loro promotore endogeno nei batteri batteri coli . Fimaging della ricombinasi IS621 marcata in modo fluorescente da ncRNA wild-type o codificato per misurare la costante di dissociazione dell'equilibrio (KDott). G, la struttura secondaria consenso degli ncRNA costruita da 103 sequenze IS110. ©
Matthew J. Durant et al.
Precisione oltre il 94%
Questo meccanismo conferisce al nuovo sistema un livello di precisione che non può essere ottenuto utilizzando CRISPR. Durante i test per i batteri Escherichia coliIl team ha dimostrato che l'efficienza dell'inserimento di un gene specifico era superiore al 60%, mentre la capacità di inserirlo nella posizione corretta era superiore al 94%.
Inoltre, questa tecnica permette di riassemblare due filamenti di DNA senza rilasciare le estremità precedentemente scisse di quest'ultimo. Queste cosiddette sequenze “cicatrici” rappresentano una grave limitazione alle tecniche di editing genetico attualmente utilizzate.
Tuttavia, è importante notare che questa tecnologia è stata finora testata solo sui batteri e la sua efficacia su altri tipi di cellule, compreso l’uomo, deve ancora essere dimostrata. Tuttavia, potrebbe eventualmente aprire la strada a nuovi tipi di terapie geniche. Secondo gli esperti, la ricerca futura si concentrerà sull’applicazione dello strumento alle cellule umane, migliorandone l’accuratezza e l’efficienza, nonché sull’esplorazione di potenziali funzioni aggiuntive.
Video esplicativo dello studio:
fonte : natura

“Pioniere del caffè a misura di hipster. Creatore amichevole. Analista pluripremiato. Scrittore. Studioso di cibo. Drogato di televisione. Ninja di Internet.”
